Внимание! Информация не предназначена для самолечения, проконсультируйтесь у специалиста.
Тарцева®, описание фармакологического действия лекарства, возможные побочные эффекты и противопоказания
|
ИНСТРУКЦИЯ
по медицинскому применению препарата
ТАРЦЕВА® (TARCEVA® )
Регистрационный номер
ЛС-001443
Торговое название препарата
Тарцева®
Международное непатентованное название
Эрлотиниб (Erlotinib)
Лекарственная форма
Таблетки, покрытые пленочной оболочкой
Состав
Одна таблетка, покрытая пленочной оболочкой, содержит:
активное вещество:
| эрлотиниб | 25 мг | 100 мг | 150 мг |
| (в виде эрлотиниба гидрохлорида | 27.32 мг | 109.29 мг | 163.93 мг); |
вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая, карбоксиметилкрахмал натрия, натрия лаурилсульфат, магния стеарат;
оболочка: гипромеллоза, гипролоза, макрогол 400, титана диоксид (Е171); допускается использование готовой смеси Opadry White Y-5-7068;
чернила для нанесения надписи на таблетке:
- желтые чернила для дозировки 25 мг - шеллак, модифицированный в этаноле денатурированном [спирте метилированном] 74 ОР, краситель железа оксид желтый (Е172), бутанол, изопропанол, пропиленгликоль, вода очищенная, этанол денатурированный [спирт метилированный] 74 ОР; допускается использование готовых чернил Opacode Yellow S-1-22970;
- серые чернила для дозировки 100 мг - шеллак, модифицированный в этаноле денатурированном [спирте метилированном] 74 ОР, титана диоксид (Е171), краситель железа оксид черный (Е172), краситель железа оксид желтый (Е172), бутанол, изопропанол, пропиленгликоль, вода очищенная, этанол денатурированный [спирт метилированный] 74 ОР, аммиака раствор концентрированный; допускается использование готовых чернил Opacode Grey S-1-27645;
- коричневые чернила для дозировки 150 мг - шеллак, модифицированный в этаноле денатурированном [спирте метилированном] 74 ОР, краситель железа оксид красный (Е172), бутанол, изопропанол, пропиленгликоль, вода очищенная, этанол денатурированный [спирт метилированный] 74 ОР, аммиака раствор концентрированный; допускается использование готовых чернил Opacode Brown S-1-26604.
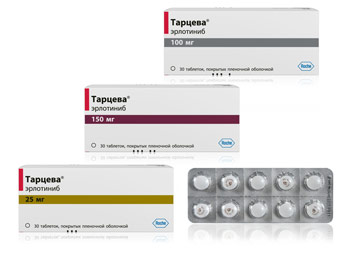
Описание
Таблетки 25 мг: круглые, двояковыпуклые, покрытые пленочной оболочкой таблетки белого или белого с желтоватым оттенком цвета; на одной стороне таблетки надпись «TARCEVA 25» оранжевого цвета и оригинальный логотип.
Размеры: диаметр 6.3-6.7 мм, толщина 3.0-3.6 мм.
Таблетки 100 мг: круглые, двояковыпуклые, покрытые пленочной оболочкой таблетки белого или белого с желтоватым оттенком цвета; на одной стороне таблетки надпись «TARCEVA 100» серого цвета и оригинальный логотип.
Размеры: диаметр 8.7-9.1 мм, толщина 4.4-5.4 мм.
Таблетки 150 мг: круглые, двояковыпуклые, покрытые пленочной оболочкой таблетки белого или белого с желтоватым оттенком цвета; на одной стороне таблетки надпись «TARCEVA 150» коричневого цвета и оригинальный логотип.
Размеры: диаметр 10.3-10.7 мм, толщина 4.9-5.9 мм.
Фармакотерапевтическая группа
Противоопухолевое средство - протеинтирозинкиназы ингибитор
Код АТХ [L01XE03]
Фармакологические свойства
Фармакодинамика
Эрлотиниб мощно ингибирует внутриклеточное фосфорилирование рецептора эпидермального фактора роста HER1/EGFR (HER1 = рецептор эпидермального фактора роста человека 1 типа/ EGFR = рецептор эпидермального фактора роста).
Экспрессия HER1/EGFR наблюдается на поверхности как нормальных, так и раковых клеток. На доклинических моделях ингибирование фосфотирозина EGFR тормозит рост линий опухолевых клеток и/или приводит к их гибели.
В первой линии поддерживающей терапии немелкоклеточного рака легкого средняя выживаемость без прогрессирования в группе препарата Тарцева® составила 22.4 недели против 16.0 недель в группе плацебо.
Фармакокинетика
Экспозиция
После приема внутрь 150 мг эрлотиниба в равновесном состоянии медиана максимальной концентрации эрлотиниба (Cmax) в плазме 1.995 нг/мл. Перед приемом следующей дозы через 24 ч медиана минимальной концентрации (Cmin) эрлотиниба в плазме 1.238 нг/мл. Медиана площади под кривой «концентрация действующего вещества - время» (AUC) в междозовом интервале при достижении равновесной концентрации составляет 41.3 мкг/ч*мл.
Всасывание
Эрлотиниб хорошо всасывается после приема внутрь. Имеет продолжительную фазу всасывания, а среднее значение времени достижения максимальной концентрации (TСmax) в плазме составляет 4 ч. Согласно данным исследования на здоровых добровольцах биодоступность эрлотиниба - 59%, прием пищи может увеличивать его биодоступность.
После всасывания в крови эрлотиниб на 95% находится в связанном состоянии, в первую очередь с белками плазмы крови (альбумин и альфа1- кислый гликопротеин).
Свободная фракция составляет приблизительно 5%.
Распределение
Кажущийся объем распределения 232 л с распределением в ткань опухоли. В образцах опухолевой ткани человека (рак легкого - 3, рак гортани - 1) на 9 день лечения эрлотинибом в дозе 150 мг в сутки средняя концентрация эрлотиниба равна 1.185 нг/г, что составляет 63% от Cmax в плазме в равновесном состоянии. Концентрация основных активных метаболитов в ткани опухоли 160 нг/г, что соответствует 113% Cmax в плазме в равновесном состоянии. Исследования по изучению распределения в тканях меченного 14С эрлотиниба после перорального приема у бестимусных мышей с мутацией по гену nude c НТ5 опухолевым ксенотрансплантатом (с использованием общей ауторадиографии) продемонстрировали быстрое и интенсивное распределение в тканях. Сmax в ткани составила около 73% концентрации эрлотиниба, TСmax в ткани - 1 ч.
Метаболизм
Эрлотиниб метаболизируется изоферментами системы цитохрома Р450 главным образом при участии изофермента CYP3А4 и в меньшей степени CYP1А2. Внепеченочный метаболизм посредством изофермента CYP3А4 в кишечнике, изофермента CYP1А1 в легких, изофермента CYP1В1 в ткани опухоли обеспечивает метаболический клиренс эрлотиниба. Исследования in vitro свидетельствуют о том, что 80-95% эрлотиниба метаболизируется при участии изофермента CYP3А4.
Метаболизм происходит тремя путями: 1) О-деметилирование одной из боковых или обеих цепей с последующим окислением до карбоновых кислот; 2) окисление ацетиленовой части молекулы с последующим гидролизом до арилкарбоновой кислоты; 3) ароматическое гидроксилирование фенилацетиленовой части молекулы. Основные метаболиты образуются в результате О-деметилирования одной из боковых цепей и обладают активностью, сравнимой с эрлотинибом в доклинических исследованиях in vitro и на моделях опухолей in vivo. Они присутствуют в плазме в концентрациях, которые составляют Выведение
Метаболиты и следовые количества эрлотиниба выводятся, преимущественно, с каловыми массами (>90%), почками выводится небольшое количество перорально введенной дозы.
Клиренс
Данные популяционного фармакокинетического анализа. При монотерапии препаратом Тарцева®
средний клиренс 4.47 л/ч, а средний период полувыведения (T1/2) 36.2 ч. Следовательно, ожидается, что равновесная концентрация будет достигнута на 7-8 день. Значительной связи между клиренсом, возрастом, массой тела, полом и расой больного не выявлено.
Фармакокинетика эрлотиниба зависела от следующих показателей: концентрации общего билирубина, альфа1-кислого гликопротеина и курения в настоящее время. Снижение клиренса эрлотиниба отмечено при повышении концентрации общего билирубина и альфа1-кислого гликопротеина, a его повышение - у курильщиков (см. раздел «Взаимодействие с другими лекарственными средствами).
Одновременное применение гемцитабина не влияло на клиренс эрлотиниба.
Фармакокинетика у особых групп пациентов
Специальные исследования у детей и пожилых пациентов не проводились.
Нарушение функции печени
Эрлотиниб в основном выводится c желчью. Экспозиция эрлотиниба одинакова у пациентов со средней степенью нарушения печеночной функции (7-9 баллов по шкале Чайлд-Пью) и у пациентов без нарушения функции печени, в том числе и у пациентов с первичным очагом опухоли в печени или с метастазами в печень.
Нарушение функции почек
Эрлотиниб и его метаболиты выводятся почками в незначительных количествах - менее 9% однократной дозы. Клинические исследования у больных с нарушением функции почек не проводились.
Курение
Курение увеличивает клиренс и снижает экспозицию эрлотиниба. AUC0-infinity у курящих людей составила 1/3 от AUC0-infinity у некурящих/бывших курильщиков. Наблюдавшееся снижение экспозиции у активных курильщиков возможно связано с индукцией изофермента CYP1A1 в легких и CYP1A2 в печени.
У курящих пациентов с немелкоклеточным раком легкого минимальная равновесная концентрация составила 0.65 мкг/мл, что в 2 раза ниже, чем у некурящих/бывших курильщиков (1.28 мкг/мл). При этом кажущийся клиренс эрлотиниба увеличивается на 24%.
При увеличении дозы эрлотиниба от 150 мг до 300 мг (максимально переносимая доза) наблюдается дозозависимое увеличение экспозиции эрлотиниба. Минимальная равновесная концентрация эрлотиниба в дозе 300 мг у курильщиков составляла 1.22 мкг/мл (см. разделы «Особые указания по дозированию» и «Взаимодействие с другими лекарственными средствами»).
Показания
Немелкоклеточный рак легкого
Поддерживающая терапия местно-распространенного или метастатического немелкоклеточного рака легкого при отсутствии прогрессирования заболевания после 4 курсов первой линии химиотерапии на основе препаратов платины.
Местно-распространенный или метастатический немелкоклеточный рак легкого после неудачи одной или более схем химиотерапии.
Рак поджелудочной железы
Первая линия терапии местно-распространенного или метастатического рака поджелудочной железы в комбинации с гемцитабином.
Противопоказания
Выраженная гиперчувствительность к эрлотинибу или к любому компоненту препарата.
Беременность и кормление грудью.
Возраст до 18 лет (безопасность и эффективность не изучались).
Тяжелое нарушение функции печени (10 и более баллов по шкале Чайлд-Пью) или почек.
С осторожностью
Нарушение функции печени.
Курение.
Пациенты с редкими наследственными заболеваниями, такими как непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция.
Одновременный прием с мощными индукторами или ингибиторами изофермента CYP3A4.
Пептическая язва или дивертикулярная болезнь в настоящее время или в анамнезе.
Одновременный прием с антиангиогенными лекарственными средствами, глюкокортикостероидами, нестероидными противовоспалительными препаратами (НПВП).
Пациенты, получающие химиотерапию, которая включает таксаны.
Способ применения и дозы
Внутрь, один раз в сутки, не менее чем за 1 ч или через 2 ч после приема пищи.
Немелкоклеточный рак легкого
По 150 мг ежедневно, длительно.
Рак поджелудочной железы
По 100 мг ежедневно, длительно, в комбинации с гемцитабином (см. также инструкцию по медицинскому применению гемцитабина, показание рак поджелудочной железы).
При появлении признаков прогрессирования заболевания терапию препаратом Тарцева® следует прекратить.
Если у пациента в течение 4-8 недель лечения не развивается сыпь, дальнейшую терапию препаратом Тарцева® следует пересмотреть.
Особые указания по дозированию
При сопутствующей терапии субстратами или модуляторами изофермента CYP3А4 может потребоваться изменение дозы препарата Тарцева®
.
При необходимости доза препарата Тарцева® снижается на 50 мг постепенно.
Нарушение функции печени
Эрлотиниб выводится путем печеночного метаболизма и билиарной экскреции. Несмотря на то, что экспозиция эрлотиниба была одинаковой у пациентов со средней степенью нарушения печеночной функции (7-9 баллов по шкале Чайлд-Пью) и у пациентов без нарушения функции печени, необходимо проявлять осторожность при назначении препарата Тарцева®
больным с нарушением функции печени. Прием препарата Тарцева®
не рекомендуется при тяжелом нарушении функции печени.
При развитии тяжелых нежелательных реакций, следует рассмотреть вопрос о снижении дозы или перерыве терапии препаратом Тарцева® . Безопасность и эффективность у пациентов с тяжелым нарушением функции печени (активность АЛТ и АСТ более чем в 5 раз выше верхней границы нормы) не изучались.
Нарушение функции почек
Безопасность и эффективность у больных с нарушением функции почек (концентрация креатинина в сыворотке крови более чем в 1.5 раза выше верней границы нормы) не изучались. Согласно фармакокинетическим данным при легкой и умеренной почечной недостаточности коррекции дозы не требуется. Прием препарата Тарцева®
не рекомендуется при тяжелом нарушении функции почек.
Детский возраст
Безопасность и эффективность препарата Тарцева®
у больных в возрасте до 18 лет не изучались.
Курение снижает экспозицию эрлотиниба на 50-60%. Максимально переносимая доза препарата Тарцева® у курящих пациентов с немелкоклеточным раком легкого составляет 300 мг.
Отдаленные результаты эффективности и безопасности применения доз выше рекомендованных в начале лечения у пациентов, продолжающих курение, не установлены.
Побочное действие
Для оценки частоты нежелательных эффектов используются следующие категории частоты: очень часто (≥1/10); часто (≥1/100, Со стороны пищеварительной системы: очень часто – диарея, тошнота, рвота, стоматит, боли в животе, метеоризм, диспепсия; часто – желудочно-кишечные кровотечения (включая отдельные случаи с летальным исходом), некоторые из которых были связаны с одновременным применением варфарина (см. раздел «Взаимодействие с другими лекарственными средствами») или НПВП; нечасто – перфорация желудочно-кишечного тракта, в некоторых случаях с летальным исходом.
Со стороны обмена веществ: очень часто – анорексия.
Со стороны гепатобилиарной системы: часто – нарушение функции печени (включая повышение активности АЛТ, АСТ, концентрации билирубина); редко – печеночная недостаточность (в том числе с летальным исходом).
Со стороны органа зрения: очень часто – конъюнктивит, сухой кератоконъюнктивит; часто – кератит; нечасто – нарушение роста ресниц, включая вросшие ресницы, избыточный рост и утолщение ресниц; очень редко – изъязвление или перфорация роговицы (см. раздел «Особые указания»).
Со стороны дыхательной системы: очень часто – одышка, кашель; часто – носовые кровотечения; нечасто – симптомы, подобные интерстициальным заболеваниям легких, включая случаи с летальным исходом.
Со стороны кожи и подкожно-жировой клетчатки: очень часто – сыпь (эритематозные и папуло-пустулезные высыпания, которые появлялись или усиливались под воздействием солнечных лучей), зуд, сухость кожи, алопеция; часто – паронихий; трещины кожи, как правило, не носящие серьезного характера, в большинстве случаев ассоциированные с сыпью и сухостью кожи; нечасто – гиперпигментация, гирсутизм, изменения ресниц/бровей, ломкость и расслоение ногтей; зарегистрированы случаи буллезного, эксфолиативного и сопровождающегося образованием волдырей поражения кожи, включая очень редкие случаи подозрения на развитие синдрома Стивенса-Джонсона/токсического эпидермального некролиза, в некоторых случаях с летальным исходом.
Со стороны нервной системы: очень часто – головная боль, невропатия.
Со стороны психики: очень часто – депрессия.
Прочие: очень часто – повышенная утомляемость, тяжелые инфекции (с или без нейтропении, пневмония, сепсис, флегмона), лихорадка, озноб, снижение массы тела.
Передозировка
Однократный прием эрлотиниба внутрь в дозе до 1000 мг здоровыми добровольцами и до 1600 мг 1 раз в неделю пациентами с онкологическими заболеваниями переносились хорошо. Однако повторный прием эрлотиниба в дозе 200 мг 2 раза в день здоровыми добровольцами уже через несколько дней переносился плохо. При приеме эрлотиниба в дозе выше рекомендованной могут наблюдаться тяжелые нежелательные явления, такие как диарея, кожные высыпания и возможно повышение активности «печеночных» трансаминаз. В случае подозрения на передозировку лечение приостанавливают и проводят симптоматическую терапию. Антидот к эрлотинибу неизвестен.
Взаимодействие с другими лекарственными средствами
Эрлотиниб у человека метаболизируется изоферментами системы цитохрома Р450 главным образом при участии изофермента CYP3А4 и в меньшей степени CYP1А2, и легочным изоферментом CYP1А1. Возможно взаимодействие при применении эрлотиниба в комбинации с ингибиторами или индукторами ферментов, а также препаратами, которые метаболизируются посредством этих ферментов.
Мощные ингибиторы изофермента CYP3А4 снижают метаболизм эрлотиниба и увеличивают его концентрацию в плазме. Ингибирование метаболизма изофермента CYP3А4 под действием кетоконазола (200 мг внутрь 2 раза в сутки в течение 5 дней) приводило к увеличению AUC эрлотиниба на 86% и Cmax на 69% по сравнению с теми же показателями при приеме одного эрлотиниба. Ципрофлоксацин (ингибитор изофермента CYP3A4 и CYP1A2) увеличивает AUC и Cmax эрлотиниба на 39% и 17% соответственно. Одновременное применение препарата Тарцева® с мощными ингибиторами изофермента CYP3А4 или CYP3А4/CYP1A2 производится только при крайней необходимости. В случае развития токсичности необходимо снизить дозу препарата Тарцева® .
Мощные индукторы изофермента CYP3А4 увеличивают метаболизм эрлотиниба и значимо снижают его концентрацию в плазме. Индукция метаболизма с участием изофермента CYP3А4 при одновременном приеме рифампицина (600 мг внутрь ежедневно в течение 7 дней) приводит к снижению медианы AUC эрлотиниба в дозе 150 мг на 69% по сравнению с приемом одного эрлотиниба.
После предварительного лечения рифампицином, а также при одновременном приеме рифампицина и препарата Тарцева® медиана AUC эрлотиниба в дозе 450 мг составляет 57.5% от AUC эрлотиниба в дозе 150 мг без предварительной терапии рифампицином. По возможности необходимо предусмотреть альтернативный метод лечения без индукции активности изофермента CYP3А4. Одновременное применение препарата Тарцева® с мощными индукторами изофермента CYP3А4, такими как рифампицин, производится только при крайней необходимости, при этом необходимо увеличить дозу препарата Тарцева® до 300 мг под тщательным контролем профиля безопасности. При хорошей переносимости при применении препарата в течение более чем 2 недель можно рассмотреть вопрос об увеличении дозы препарата до 450 мг, продолжая тщательно контролировать профиль безопасности (см. раздел «Особые указания»). Более высокие дозы в подобных ситуациях не изучались.
Субстраты изофермента CYP3A4. Предшествующая терапия или одновременный прием препарата Тарцева® не нарушает клиренс типичных субстратов изофермента CYP3A4, таких как мидазолам и эритромицин. Таким образом, значительное влияние препарата Тарцева® на клиренс других субстратов изофермента CYP3A4 маловероятно. Оказалось, что биодоступность мидазолама при пероральном приеме снижается на 24%, что не связано с влиянием на активность изофермента CYP3A4.
Омепразол. Растворимость эрлотиниба зависит от рН. При повышении рН растворимость эрлотиниба снижается. Таким образом, препараты, изменяющие рН в верхних отделах желудочно-кишечного тракта, могут оказывать влияние на растворимость эрлотиниба и его биодоступность. При одновременном приеме препарата Тарцева® и омепразола, ингибитора протонной помпы, AUC и Cmax эрлотиниба снижались на 46% и 61% соответственно. ТСmax и период полувыведения не изменялись. При одновременном приеме препарата Тарцева® и ранитидина (300 мг), блокатора H2-гистаминовых рецепторов, AUC и Cmax эрлотиниба снижались на 33% и 54% соответственно.
Таким образом, по возможности следует избегать одновременного приема препарата Тарцева® и средств, понижающих секрецию желез желудка. Маловероятно, что увеличение дозы препарата Тарцева® при одновременном приеме с подобными препаратами может компенсировать снижение его экспозиции. Однако в тех случаях когда Тарцева® назначалась в разные часы, т.е. за 2 ч до или через 10 ч после приема ранитидина (150 мг 2 раза в сутки), AUC и Cmax эрлотиниба снижались только на 15% и 17% соответственно. В случае необходимости терапии данными препаратами следует отдавать предпочтение приему блокаторов H2-гистаминовых рецепторов, таким как ранитидин, в разные часы. Следует принимать препарат Тарцева® по крайней мере за 2 ч до или через 10 ч после приема блокатора H2-гистаминовых рецепторов.
Варфарин, другие производные кумарина. У пациентов, получавших препарат Тарцева® в комбинации с производными кумарина, включая варфарин, зарегистрированы повышение Международного нормализованного отношения (МНО) и кровотечения, в отдельных случаях с летальным исходом. У больных, принимающих производные кумарина, необходимо регулярно контролировать протромбиновое время или МНО.
Статины. Тарцева® в комбинации со статинами может усиливать миопатию, вызванную статинами, включая рабдомиолиз, наблюдавшийся редко.
Курение. Следует рекомендовать отказ от курения при применении препарата, поскольку курение, индуцируя изоферменты CYP1A1 и CYP1A2, снижает экспозицию эрлотиниба на 50-60%.
Гемцитабин. Не выявлено значительного влияния гемцитабина на фармакокинетику эрлотиниба и наоборот.
Препараты платины. Эрлотиниб увеличивает концентрацию платины в плазме крови. Одновременный прием эрлотиниба с карбоплатином и паклитакселом приводит к статистически значимому, но не значимому клинически повышению AUC общей платины на 10.6%. Повышение экспозиции карбоплатина может быть связано с другими факторами, например нарушением функции почек. Не выявлено значительного влияния карбоплатина или паклитаксела на фармакокинетику эрлотиниба.
Капецитабин. Капецитабин увеличивает концентрацию эрлотиниба в плазме крови. Применение эрлотиниба в комбинации с капецитабином по сравнению монотерапией эрлотинибом приводит к статистически значимому повышению AUC эрлотиниба и незначительному повышению Cmax эрлотиниба. Не выявлено значительного влияния эрлотиниба на фармакокинетику капецитабина.
Субстраты UGT1A1. Поскольку эрлотиниб является ингибитором УДФ-глюкуронилтрансферазы UGT1A1, возможно взаимодействие с препаратами, которые являются субстратами UGT1A1 и для которых реакция конъюгации с глюкуроновой кислотой является основным путем метаболизма. Необходимо соблюдать осторожность при назначении препарата Тарцева® пациентам с низким уровнем экспрессии UGT1A1 или с генетическими нарушениями, вызывающими снижение скорости реакции глюкуронизации (например, синдромом Жильбера), поскольку возможно повышение концентрации билирубина в плазме крови.
Особые указания
Интерстициальное заболевание легких (ИЗЛ). У больных с немелкоклеточным раком легкого, раком поджелудочной железы или другими распространенными солидными опухолями, получавших препарат Тарцева® , ИЗЛ-подобные симптомы, в том числе с летальным исходом, диагностировались нечасто. Общая частота случаев ИЗЛ-подобных явлений у пациентов, получавших препарат Тарцева® , составляет 0.6%. Наиболее частыми диагнозами у больных с подозрением на ИЗЛ-подобные симптомы являются: пневмонит, интерстициальная пневмония, лучевой пневмонит, аллергический интерстициальный пневмонит, интерстициальное заболевание легких, облитерирующий бронхиолит, фиброз легких, острый респираторный дистресс-синдром, инфильтрация легких и альвеолит.
Перечисленные ИЗЛ-подобные явления возникали в период от несколько дней до нескольких месяцев после начала терапии препаратом Тарцева® . Большинство случаев было связано с отягчающими или способствующими факторами, такими как сопутствующая или ранее проводимая химиотерапия, лучевая терапия, паренхиматозное заболевание легких в анамнезе, метастатическое поражение легких или инфекция. При остром развитии новых и/или прогрессировании необъяснимых легочных симптомов (одышка, кашель и лихорадка) прием препарата Тарцева® необходимо временно прекратить до выяснения причины. В случае подтверждения диагноза ИЗЛ необходимо отменить препарат Тарцева® и провести необходимое лечение.
Диарея, дегидратация, электролитные нарушения и почечная недостаточность. При возникновении тяжелой или умеренной диареи необходимо назначить лоперамид. В некоторых случаях может потребоваться снижение дозы препарата Тарцева® .
При тяжелой или устойчивой диарее, тошноте, анорексии или рвоте с обезвоживанием, терапия препаратом Тарцева® должна быть прервана и проведена регидратация. Сообщалось о редких случаях развития гипокалиемии и почечной недостаточности, в том числе с летальным исходом.
Некоторые случаи почечной недостаточности были вызваны тяжелой дегидратацией вследствие диареи, рвоты и/или анорексии, другие - сопутствующей химиотерапией. В случаях тяжелой или устойчивой диареи или состояниях, приводящих к дегидратации, особенно у пациентов в группе риска (сопутствующая терапия или заболевания, или при наличии других предрасполагающих факторов, в том числе пожилой возраст), препарат Тарцева® временно отменяют и проводят парентеральную регидратацию. У пациентов с высоким риском дегидратации следует контролировать электролиты сыворотки крови, включая калий, и функцию почек.
Гепатит, печеночная недостаточность. Во время приема препарата Тарцева® сообщалось о редких случаях печеночной недостаточности, включая случаи с летальным исходом. Рекомендуется периодически контролировать функцию печени пациентам с сопутствующими заболеваниями печени или получающим гепатотоксичные лекарственные средства. При развитии тяжелого поражения печени прием препарата Тарцева® прекращают.
Экспозиция эрлотиниба была одинаковой у пациентов со средней степенью нарушения печеночной функции (7-9 баллов по шкале Чайлд-Пью) и у пациентов без нарушения функции печени, в том числе у пациентов с первичным очагом опухоли в печени или метастазами в печени. Безопасность и эффективность препарата Тарцева® у пациентов с тяжелым нарушением функции печени не изучались.
Перфорация желудочно-кишечного тракта. Пациенты, получающие препарат Тарцева® , имеют повышенный риск развития перфорации желудочно-кишечного тракта, наблюдавшиеся нечасто, в некоторых случаях с летальным исходом. В группу повышенного риска входят пациенты, получающие сопутствующую терапию антиангиогенными препаратами, глюкокортикостероидами, НПВП и/или химиотерапию на основе таксанов, или пациенты, имеющие в анамнезе пептическую язву или дивертикулярную болезнь.
В случае развития перфорации желудочно-кишечного тракта терапию препаратом Тарцева® следует прекратить.
Буллезные или эксфолиативные нарушения. Сообщалось о случаях буллезных, сопровождающихся образованием волдырей и эксфолиативных нарушений, в том числе об очень редких случаях подозрения на развитие синдрома Стивенса-Джонсона/токсического эпидермального некролиза, в некоторых случаях с летальным исходом. В случае развития тяжелых буллезных, сопровождающихся образованием волдырей или эксфолиативных поражений кожи, лечение препаратом Тарцева® должно быть приостановлено или прекращено.
Офтальмологические нарушения. При применении препарата Тарцева® зарегистрированы очень редкие случаи перфорации или изъязвления роговицы. При лечении препаратом Тарцева® наблюдались и другие офтальмологические нарушения, включая неправильный рост ресниц, сухой кератоконъюнктивит или кератит, которые также являются факторами риска развития перфорации/изъязвления роговицы. Лечение препаратом Тарцева® должно быть приостановлено или отменено при появлении острых офтальмологических симптомов, таких как боль в глазу, или ухудшении хронических офтальмологических заболеваний.
Во время лечения препаратом Тарцева® и как минимум в течение 2-х недель после его окончания следует применять надежные методы контрацепции.
Влияние на способность управлять автомобилем и работу с механизмами
Исследования по изучению влияния препарата на способность управлять автомобилем и работать с механизмами не проводились. Однако эрлотиниб не влияет на способность к концентрации внимания.
Форма выпуска и упаковка
Таблетки, покрытые пленочной оболочкой, 25 мг, 100 мг и 150 мг
По 10 таблеток в блистер из ПВХ/Al.
3 блистера вместе с инструкцией по применению помещают в картонную пачку.
Срок годности
3 года. Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
При температуре не выше 30°С.
Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Владелец Регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Грензахерштрассе 124, 4070 Базель, Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Шварц Фарма Мануфектуринг Инк, 1101 С Авеню Вест, Сеймур, ИН 47274, США
Schwarz Pharma Manufacturing Inc, 1101 C Avenue West, Seymour, IN 47274, USA
Ф. Хоффманн-Ля Рош Лтд., Грензахерштрассе 124, 4070 Базель, Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland
Претензии потребителей направлять по адресу Представительства Ф.Хоффманн-Ля Рош Лтд.:
107031, Россия, г. Москва, Трубная площадь, д. 2
Зарубежное название лекарства: Tarceva®
Дополнительные изображения лекарственного средства Тарцева®
На этой странице Вы можете получить максимум информации о таком лекарственном средстве как Тарцева®.
Прочитайте описание и показания лекарственного средства Tarceva®, узнайте о возможных побочных эффектах и противопоказаниях.
Узнав про действующее вещество и фармакологическое действие такого лекарства как Тарцева® Вам станет понятно при лечении каких заболеваний может быть использовано лекарственное средство и к какому врачу обратиться для прохождения медицинских мероприятий и избежания тяжелых последствий и осложнений.
Использование фармакологических препаратов не рекомендуется с точки зрения долговременного здоровья, а также у большинства препаратов имеются противопоказания к применению.
Так же вы сможете посмотреть фото лекарственного средства и узнать возможны ли побочные действия при принятии Тарцева® и других лекарств одновременно, а также цены в ближайших аптеках и альтернативы данному лекарственному средству.
Описание препарата Тарцева® не предназначено для назначения лечения без участия врача.